膜体系酵母双杂交文库构建
一. 相关应用
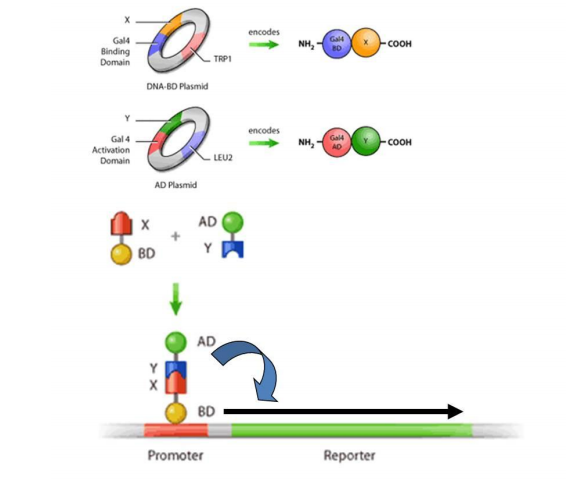
酵母双杂交(yeast two hybrid) 技术是利用酵母遗传学方法分析蛋白质之间的相互作用,已被广泛应用于蛋白质组学、细胞信号转导和功能基因组学等领域,已成为分子生物学研究领域的重要实验手段。该方法建立以来,经过不断的完善和发展,不但可以检测已知蛋白质之间的相互作用,更重要的在于发现与已知蛋白相互作用的未知蛋白。目前已知的蛋白质相互作用至少有一半是通过酵母双杂交实验发现的。 而文库筛选结果直接由文库质量的好坏所决定,构建出高质量的文库是得到好的筛选结果的关键因素。但是,传统的酵母双杂交系统仅限于核蛋白的互作分析,不能进行膜蛋白互作的研究。
但是,传统的酵母双杂交系统(核体系)仅限于核蛋白的互作分析,无法检测胞膜蛋白 质间相互作用,不少蛋白质需在内质网或细胞质中经过转录后修饰,才能与其他蛋白质 发生相互作用,传统的酵母双杂交无法检测,有些蛋白质本身就是转录激活因子,可以对报告基因的表达进行调控,传统的酵母双杂交也无法检测。
DUALmembrane 系统 (DUALmembrane system)由瑞士的Dualsystems Biotech AG 公司开发出来,是基于分离的泛素(split-ubiquitin)介导的膜蛋白酵母双杂交系统,它提供了不同于常规酵母双杂交系统的蛋白体内分析方法,使得分析膜蛋白间的互作成为现实。我们采用DUALmembrane膜蛋白酵母双杂交系统,DUALmembrane 技术突破了传统酵母双杂交的局限,扩大 了酵母双杂交的应用范围。
主要特点是可以进行膜蛋白-膜蛋白、膜蛋白-可溶性蛋白间的互作研究。它既可以用于表达文库的筛选,也可以应用于两个已知蛋白(其中一个属于膜蛋白)间互作关系的验证。
二.实验原理
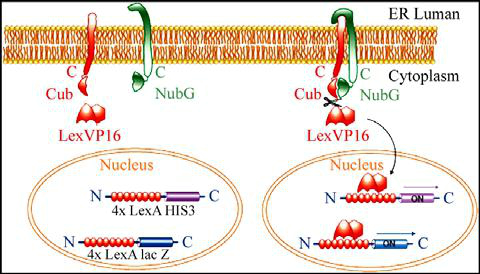
该系统由分离的泛素(split-ubiquitin)介导膜蛋白互作信号的识别。泛素是一种含76个氨基酸的保守蛋白,它经常作为降解信号连接在蛋白质的N端。泛素能被其特异性的蛋白酶(ubiquitin-specific proteases, UBPs)识别并从所连接的蛋白上切割下来,切割位点总是位于泛素蛋白的C端。在酵母细胞中,泛素可以分成两部分分别表达,即其N端部分(NubI,第1~34位氨基酸)和C端部分(Cub,第35~76位氨基酸),后者融合了启动核内报告基因表达的LexA蛋白。NubI和Cub-LexA在细胞中组成可分离的泛素蛋白([NubI:Cub]-reporter)体系。
野生型NubI与Cub具有高亲和力并能自发重组形成异源二聚体。当野生型NubI的第13位异亮氨酸被丙氨酸或甘氨酸取代后,NubG与Cub之间的亲和力降低。于是NubG与Cub-LexA之间只有依靠蛋白互作而连接起来,两个互作蛋白分别与NubG和Cub-LexA融合。这样,通过检测转录因子LexA的切割就可以检测两个蛋白之间的互作关系,该系统工作原理示意图如图1。当位于细胞内质网膜上的两个蛋白发生相互作用时,分别融合于其氨基酸C端的泛素蛋白前半部分(Cub)和后半部分(NubG)因距离靠近而形成一个完整的泛素蛋白分子,于是诱导UBPs识别并于其C端进行剪切,从而释放出转录因子LexA,最终启动核报告基因(HIS3和lacZ)的转录。HIS3作为营养缺陷型选择标记,而lacZ转录后的β-Gal活性则作为阳性克隆的主要选择性标记。VP16作为诱饵融合蛋白的识别标签用于融合蛋白的表达和定位检测。
三.交付结果:
产品名称 | 交付形式 | 交付标准 | 运输 条件 | 储存 条件 |
文库构建报告电子版 | Word或PDF格式 | 常温 | ||
文库构建图片 | JPG格式 | 常温 | ||
酵母转化报告电子版 | 2ml冻存管(3管) | Word或PDF格式 | 常温 | |
初级文库质粒 | 2ml冻存管(1管) | >100ug | 干冰 | -80℃ |
次级文库菌液 | 2ml冻存管 (3管) | 20%甘油 | 干冰 | -80℃ |
次级文库质粒 | 2ml冻存管(1管) | >100ug | 干冰 | -80℃ |
酵母工作液 | 2ml管(100管) | 干冰 | -80℃ | |
酵母母液 | 50ml管(3管) | 干冰 | -80℃ | |
筛库的菌液和质粒 | 各一管 | 干冰 | -80℃ | |
酵母双杂交文库质量指标:
文库容量1*107 CFU ; 重组率:≥95 % ;插入片断平均大于1.2 kb;
四.项目周期
25-30个工作日内,如需转化酵母延长10个工作日。
五.技术特色
1. 采用同源重组的方法构建文库,没有经过任何的内切酶切割和连接过程,确保不会出现基因被酶切切断的情况,能够保证基因的完整性。
2. 承诺原始库的库容量在0.5-1*107以上,而且重组的方式假阳性很低, 承诺阳性率大于 95%。
六. 合作项目
目前,在全国我们已经成功完成几千个酵母双杂交文库构建,主要物种包括人、小鼠、大鼠、水稻、拟南芥、牡丹、稻飞虱、荔枝、柑橘、苹果、油菜、小麦、对虾、贝壳、葡萄、烟草、黄瓜、香蕉、大豆、牵牛花、木瓜、茄子等。
七.重要提醒
1. 客户收到我们寄去的产品需检查干冰是否充足,菌液是否有溶解现象,如果没有干冰,文库质量会受到很大影响,要尽快跟我们联系采取补救措施。
2. 客户拿到我们提供的所有产品均需-80℃保存,酵母菌液一定不能反复冻融。
3. 客户拿到我们的文库需尽快涂 SD/-Leu 平板验证文库滴度,如果文库滴度达到 107
八.常见问题及解决方案
1.如果诱饵蛋白对酵母细胞是有毒的,该怎么办?
在某些情况下,在液体培养基中培养不好的菌珠可以在固体培养基上生长得很好。首先重悬克隆于 1ml 的 SD/–Trp,接着将重悬液平铺于 5 个 100-mm 的 SD/–Trp 平板,在 30℃下温浴,直至平板上的克隆相互粘在一起。用 5ml 0.5X YPDA 刮下每块板上的克隆,并收集到一管中,这样就可以使用这个细胞重悬液进行正常的杂交反应。
2. 如果诱饵蛋白能直接激活报告基因的表达,该如何处理?
该蛋白很可能有转录激活域,是个转录因子。可以通过基因重组切掉转录激活域,
然后重新检测其是否自激活,但要注意重组也有可能破坏蛋白之间的互作。
3. 转化效率太低怎么办?
1) 检测一下 DNA 的纯度,如果可以的话,重新用乙醇纯化。
2) DNA-BD/诱饵蛋白很可能是有毒的。
3) 不适当的培养基,重新配制培养基,并做对照转化。
4) 检测 pGBT9 对照载体的转化效率,放置于 SD/–Trp 平板上,转化效率应该在 1 x 105 colonies/mg DNA 以上。
4. 杂交效率不高,该如何处理?
在杂交中,预转化的诱饵细胞的数量可能不够。当对诱饵菌株进行液体培养过夜时,
应挑选大的、新鲜的克隆进行培养,经过离心和重悬后,再使用血球计对细胞进行计数。
密度应该在 1 x 109/ml。
一个甚至两个融合蛋白对酵母细胞有毒。你可以通过重组方法来减轻毒性,同时又
能保证蛋白的相互作用。或者使用表达水平较低的载体。也可以在琼脂平板或滤膜上进
行杂交。但同时必须作杂交对照实验。

访问手机版

微信公众号